Science:新模型有助于解释细胞分裂时如何保存细胞身份
来源:生物谷原创 2023-11-30 10:23
人体内的每个细胞都含有相同的遗传指令,这些指令编码在细胞的 DNA 中。然而,在大约 3 万个基因中,每个细胞只表达它成为神经细胞、免疫细胞或其他数百种细胞类型所需的基因。
人体内的每个细胞都含有相同的遗传指令,这些指令编码在细胞的 DNA 中。然而,在大约 3 万个基因中,每个细胞只表达它成为神经细胞、免疫细胞或其他数百种细胞类型所需的基因。
每个细胞的命运主要由修饰它的DNA 的蛋白进行的化学修饰决定;这些修饰反过来又控制着哪些基因开启或关闭。然而,当细胞复制 DNA 进行分裂时,它们会失去一半的化学修饰,这就留下了一个问题:细胞如何保持它们应该是哪种细胞的记忆?

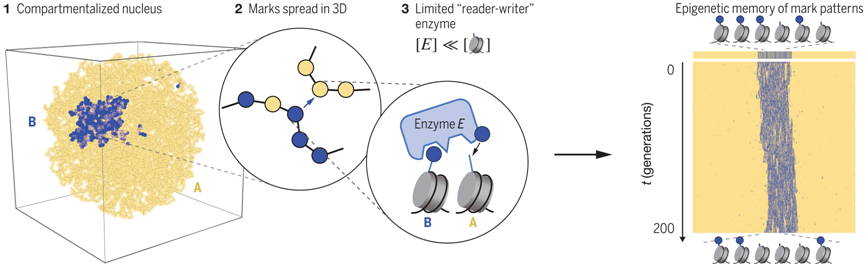
在一项新的研究中,来自美国麻省理工学院的研究人员提出了一种有助于解释细胞分裂时这些记忆如何代代相传的理论模型。他们认为,在每个细胞的细胞核内,它的基因组的三维折叠模式决定了基因组的哪些部分会被这些化学修饰所标记。相关研究结果发表在2023年11月17日的Science期刊上,论文标题为“Design principles of 3D epigenetic memory systems”。
在细胞复制它的DNA 后,这些标记会部分丢失,但是它的基因组三维折叠可以让每个子细胞轻松恢复保持它的身份所需的化学标记。每次细胞分裂时,化学标记都能让细胞恢复它的基因组的三维折叠。这样,通过在三维折叠和化学标记之间进行转换,细胞身份记忆可以在数百次细胞分裂中得以保存。
论文第一作者Jeremy Owen博士说,“细胞类型差异的一个关键方面是不同基因的开启或关闭。要将一种细胞类型转变为另一种细胞类型非常困难,因为这些状态都非常稳定。我们在这项新研究中所做的是建立一种简单的模型,突出细胞内化学系统的定性特征,以及它们需要如何发挥作用才能使基因表达记忆稳定。”
保持记忆
在细胞核内,DNA缠绕在称为组蛋白的蛋白上,形成一种称为染色质的密集结构。组蛋白可以进行多种修饰,帮助控制特定细胞中哪些基因表达。这些修饰会产生“表观遗传记忆”,帮助细胞保持它的细胞类型。然而,这种记忆如何传递给子细胞还是个谜。
论文通讯作者、麻省理工学院医学工程与科学研究所的Leonid Mirny教授及其团队之前的研究已表明发生折叠的染色体的三维结构部分上是由这些表观遗传修饰或标记决定的。特别地,他们发现,某些携带告诉细胞不要读取特定DNA片段的表观遗传标记的染色质区域会相互吸引,形成称为异染色质(heterochromatin)的致密团块,从而使得细胞很难访问这些区域。
在这项新的研究中,Mirny和他的同事们想解答的问题是,这些表观遗传标记是如何代代相传的。他们建立了一种带有少量标记区域的聚合物计算模型,发现这些标记区域会相互塌陷,形成一个致密的团块。然后,他们研究了这些标记是如何丢失和获得的。
当一个细胞复制其 DNA 并在两个子细胞之间进行分配时,每个DNA拷贝都会获得大约一半的表观遗传标记。然后,细胞需要在 DNA 传递给子细胞之前恢复丢失的表观遗传标记,而染色体折叠的方式为这些剩余表观遗传标记的去向提供了蓝图。
这些表观遗传修饰是由称为“读取-写入(reader-writer)”酶的专门酶来添加的。这些酶中的每种都对特定标记具有特异性,一旦它们“读取”了现有标记,就会在附近位置“写入”更多标记。如果染色质已经折叠成三维形状,表观遗传标记就会在已从母细胞继承了表观遗传修饰的区域积累。
Owen说,“有一些证据表明,扩散可以在三维空间中发生,也就是说,如果有两个部分在空间上相互靠近,即使它们在DNA上并不相邻,那么扩散也可以从一个部分扩散到另一个部分。这就是三维结构如何影响这些标记的扩散。”
三维表观遗传记忆的设计原理。图片来自Science, 2023, doi:10.1126/science.adg3053。
这一过程类似于传染病的传播,因为染色质区域与其他区域的接触越多,它就越有可能被改变,就像对某种疾病易感的个体随着接触次数的增加而更有可能被感染一样。在这个比喻中,异染色质的密集区域就像人们有许多社会交往的城市,而基因组的其他部分则相当于人口稀少的农村地区。
Mirny说,“这基本上意味着,在密集区域内,表观遗传标记将无处不在,而在密集区域之外的任何地方,表观遗传标记都将非常稀少。”
他补充说,这种新模型表明,存储在折叠聚合物中的表观遗传记忆与存储在神经网络中的记忆之间可能存在相似之处。可以认为,表观遗传标记的模式类似于神经网络中共同放电的神经元之间形成的连接模式。
他说,“这大致表明,与神经网络能够进行非常复杂的信息处理的方式类似,我们所描述的表观遗传记忆机制可能能够处理信息,而不仅仅是存储信息。”
表观遗传侵蚀
虽然这种模型似乎很好地解释了表观遗传记忆是如何保持的,但是这些作者发现,读取-写入酶的活性最终会导致整个基因组被表观遗传修饰覆盖。当他们改变这种模型,使该酶的作用减弱时,它没有覆盖足够的基因组,记忆在几代细胞中就丢失了。
为了让这种模型更准确地解释表观遗传标记的保存,这些作者增加了另一个因素:限制可用的读取-写入酶的数量。他们发现,如果该酶的数量保持在组蛋白数量的0.1%到1%之间(这一百分比是根据这些酶的实际丰度估算的),他们的模型细胞就能准确地保持其表观遗传记忆长达数百代,具体取决于表观遗传模式的复杂程度。
人们已经知道,随着年龄的增长,细胞开始失去它们的表观遗传记忆。这些作者如今计划研究他们在这篇论文中描述的过程是否可能在表观遗传侵蚀和细胞身份丧失中发挥作用。他们还计划模拟一种叫做早衰症(progeria)的疾病,这种疾病中的细胞发生基因突变,可导致异染色质的丧失。患有这种疾病的人会加速衰老。
Owen说,“这些突变与最终发生的表观遗传变化之间的机理联系还不是很清楚。如果能使用我们这样的模型,将动态标记与聚合物动态结合起来,就能很好地解释这一点。”
这些作者还希望与合作者一起,通过改变活细胞中读取-写入酶的水平,并测量其对表观遗传记忆的影响,对其模型的一些预测进行实验验证。(生物谷 Bioon.com)
参考资料:
Jeremy A. Owen et al. Design principles of 3D epigenetic memory systems. Science, 2023, doi:10.1126/science.adg3053.
3D folding of the genome: Theoretical model helps explain how cell identity is preserved when cells divide
https://phys.org/news/2023-11-3d-genome-theoretical-cell-identity.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


